近年来,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)在肿瘤治疗中大放异彩,尤其是靶向 PD-1/PD-L1 通路的单抗药物,已成为多种恶性肿瘤的一线疗法。然而,仅有一部分患者获得长期缓解,大量患者对治疗反应有限,严重制约了其普适性应用。
为寻找疗效差异的决定因素,东京国立癌症中心等机构组成的研究团队开展深入研究,近期在 Nature 期刊发表论文,题为“Microbiota-driven antitumour immunity mediated by dendritic cell migration”。该研究聚焦肠道微生物组与免疫疗法之间的相互作用,发现特定肠道菌株 YB328 通过激活 CD103⁺CD11b⁻ 树突状细胞的迁移与抗原呈递功能,显著增强肿瘤微环境中 CD8⁺T 细胞的抗肿瘤活性,使 PD-1 阻断疗法疗效提升 3 倍以上。

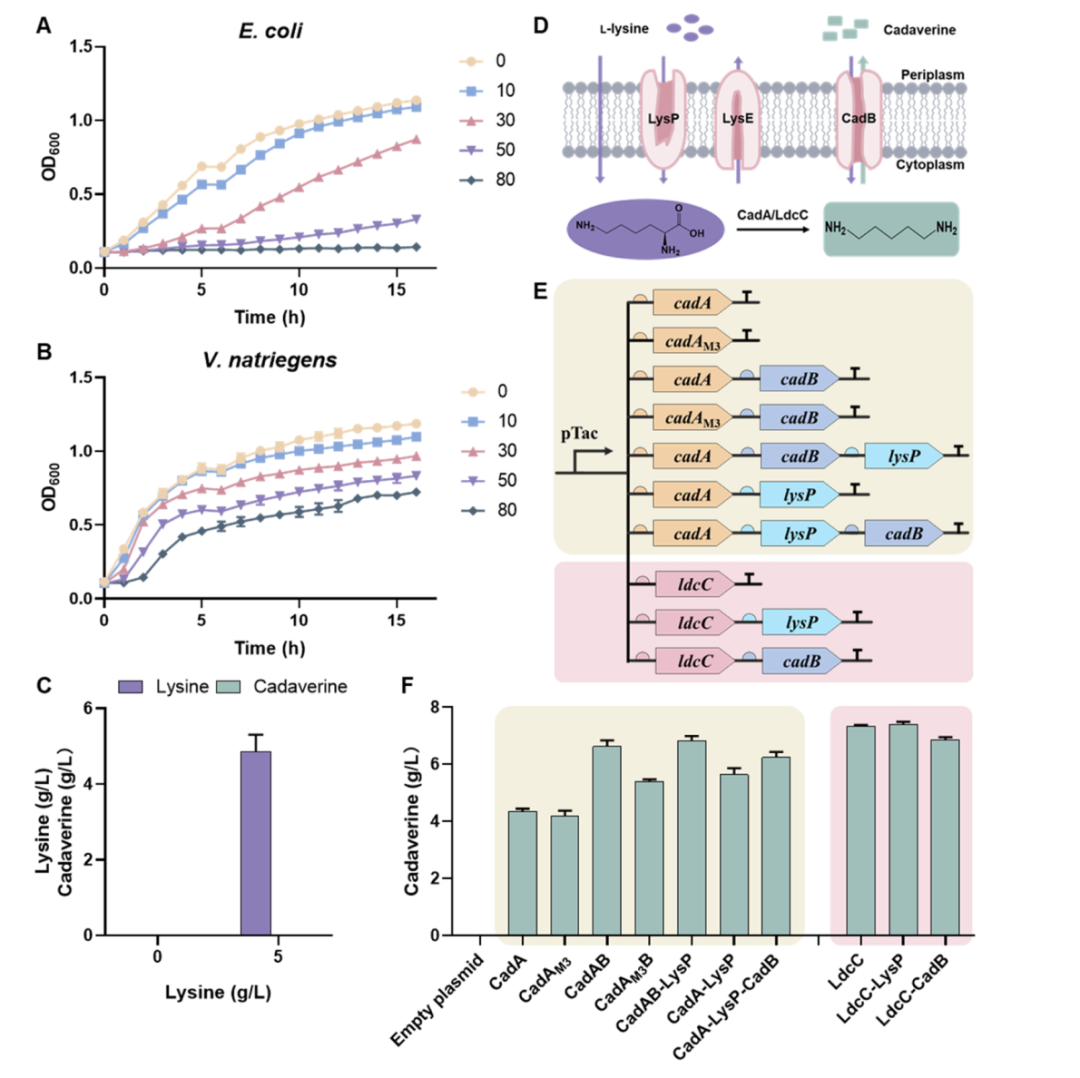
在本研究中,研究人员从 50 名接受 PD-1 单抗治疗的癌症患者中收集了粪便样本,按疗效将其划分为响应者与非响应者。他们发现,响应者的肠道菌群多样性显著高于非响应者,并富集了一些特定菌群,尤其是人肠微菌属成员。为了验证这些菌群是否直接参与抗肿瘤反应,研究团队进行了粪菌移植实验:将来自响应者与非响应者的菌群分别植入无菌小鼠体内,随后在小鼠中注射肿瘤细胞并接受 PD-1 治疗。结果显示,只有接受响应者菌群的小鼠对治疗产生明显反应,提示特定肠道菌可能具备增强免疫治疗效果的能力。通过菌株筛选与功能验证,研究者最终鉴定出一株此前未被深入研究的菌种——YB328。
为了确认 YB328 是否足以独立增强 PD-1 免疫疗法的疗效,研究者将其单独或与 PD-1 抗体联合投喂给不同小鼠模型。结果显示,YB328 本身对肿瘤生长几乎无直接抑制作用,但一旦与 PD-1 抗体联用,其协同作用显著。肿瘤体积显著缩小,CD8⁺ T 细胞浸润增加,小鼠存活率提升。更重要的是,即便在非响应者菌群背景下添加 YB328,依然能显著增强 PD-1 的疗效,提示其具备微生态“干预优势”,能够在原本免疫无应答的菌群中扭转局势。值得一提的是,YB328 联合 PD-1 抗体的增强疗效不仅在 MC38 结肠癌模型中观察到,在 B16F10 黑色素瘤、MB49 膀胱癌及 LLC1 肺癌等多种免疫背景各异的小鼠肿瘤模型中亦获得验证,显示出良好的适应性与通用性。
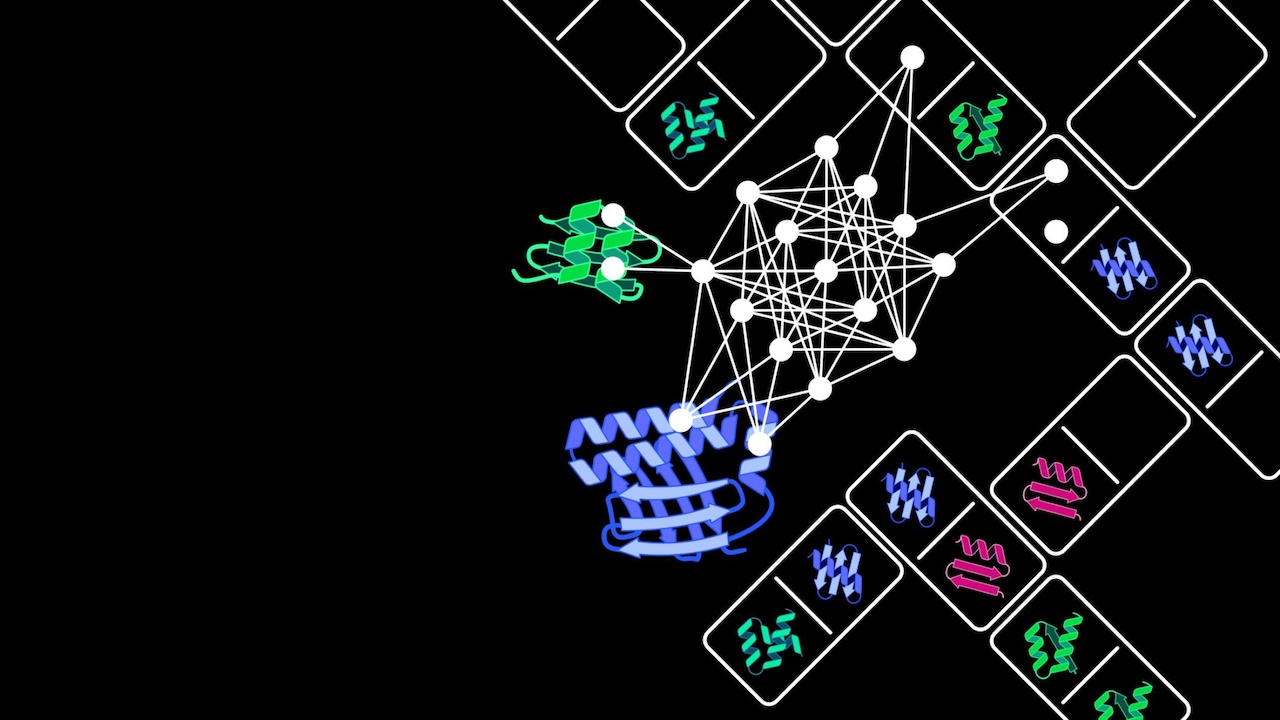
YB328 的核心作用机制源于其对一类关键免疫细胞——CD103⁺CD11b⁻常规树突状细胞(cDCs)的强烈诱导与激活。在免疫系统中,cDCs 承担着抗原识别与传递的枢纽任务,尤其是在抗病毒与抗肿瘤过程中,通过“交叉呈递”将外源抗原展示给 CD8⁺ T 细胞,进而启动细胞毒性免疫反应。研究表明,YB328 能够在小肠黏膜内促使这类 cDCs 定向分化,并迁移至肿瘤引流淋巴结和肿瘤微环境。其迁移过程依赖 CCR7 信号轴,是完成“远程调控”的关键节点。进入肿瘤区域后,YB328 诱导的 cDCs 能与 CD8⁺ T 细胞形成稳定免疫突触,增强其活化程度,并显著上调 PD-1 表达,这种早期 PD-1 表达是 T 细胞被激活的标志,而非传统意义上的“耗竭”迹象。进一步实验还发现,在缺乏 cDCs 的 Batf3−/−小鼠中,YB328 的免疫增强效应完全消失,确认这一树突状细胞亚群在机制中的核心地位。
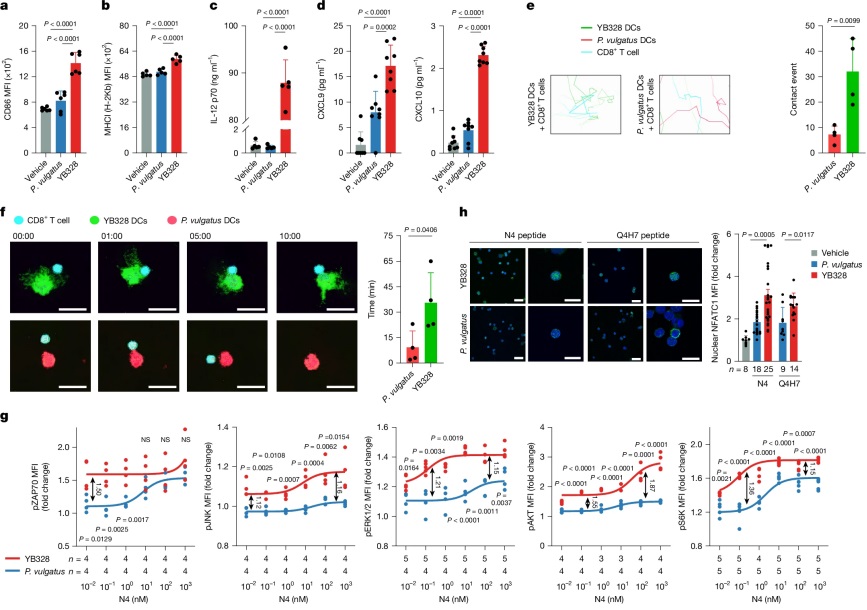
图|YB328 在肠道中诱导 CD103⁺CD11b⁻树突状细胞成熟并迁移至肿瘤
更系统的细胞实验揭示了 YB328 如何在体外激活免疫。研究者将其与骨髓来源树突状细胞(BMDCs)共培养,发现这些细胞出现明显的成熟形态特征,如细胞体积增大、伪足延展,并伴随着 CD86、CD80、MHC-I 等共刺激分子的显著上调。与此同时,这些 DCs 还高水平分泌 IL-12p70、CXCL9、CXCL10与CCL5 等细胞因子和趋化因子,构建出利于 CD8⁺ T 细胞招募与激活的免疫环境。而与之对照的 P. vulgatus 处理组则基本无此效应,突显 YB328 的特异性与强效性。
YB328 诱导的 DC 不仅能在高抗原剂量下激活 CD8⁺ T 细胞,甚至在极低剂量条件下,也能触发 ZAP70 磷酸化、NFATC1 核转位等 TCR 信号通路,显著降低T细胞的激活阈值。更进一步,T 细胞的 JNK、ERK1/2、AKT 与 S6 激酶通路也被显著激活,这些路径对于 T 细胞的增殖与功能维持至关重要。这表明,YB328 不仅提升了抗原呈递效率,也系统性重塑了 T 细胞激活程序,是一种从根本上增强免疫应答的多层调控因子。
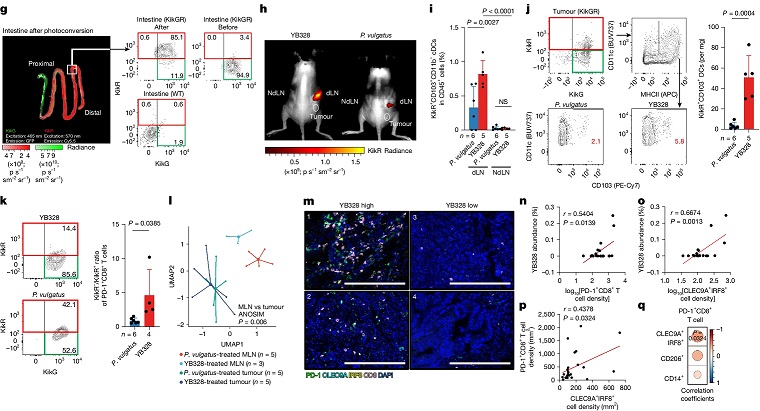
图 | YB328 诱导 cDC 分化与迁移至 TME,增强 CD8⁺ T 细胞应答
分子水平上,YB328 通过激活 TLR7、TLR8、TLR9 等内体受体,启动 MYD88 依赖的信号通路,并进一步激活 mTOR-S6K 与 STAT3 等关键转录程序,驱动 CD103⁺CD11b⁻ cDC 的谱系分化。在 Myd88 缺失小鼠或信号抑制条件下,YB328 完全丧失诱导 cDC 和提升疗效的能力,进一步确立其 TLR-MYD88 轴的依赖性。此外,在混合菌生态条件下,YB328 仍能在非响应者菌群背景中稳定定植并产生效应,但若与 P. vulgatus 共投喂则被竞争性排斥,提示临床应用时需优化其菌群适应性与共生策略。
本研究不仅识别出一株具备显著免疫调节功能的优势肠道菌 YB328,更建立了完整的“肠道菌-cDC 迁移-CD8⁺ T 细胞激活-增强 PD-1 疗效”的因果链条。这种通过“远程控制”免疫微环境的策略,为合成生物学与免疫疗法结合提供了新范式。下一步研究将聚焦于临床转化,包括 YB328 制剂开发、与 PD-1 抗体联合的临床试验设计及与其他益生菌的协同研究。肠道菌群与免疫疗法的交汇,或将成为下一阶段抗癌治疗的重要突破口。
目前,该团队正在与一家生物技术公司合作,计划在未来三年内启动一项试验,以测试 H. mulieris 是否可以改善人们对检查点抑制剂的反应。
参考链接:
1.Lin, N.YT., Fukuoka, S., Koyama, S. et al. Microbiota-driven antitumour immunity mediated by dendritic cell migration. Nature (2025). https://doi.org/10.1038/s41586-025-09249-8
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。



































































































































































































安各洛(深圳)生物科技有限公司 版权所有