氨基酸是蛋白质的基本组成部分。然而,自然界中 20 种标准氨基酸的化学多样性有限,这对药物研发、合成生物学和新材料科学形成了一定制约。
近年来,科学界越来越关注“非天然氨基酸” (ncAA) 的合成,这类分子常携带硫、硒、叠氮或氮杂芳香环等特殊基团,不仅能赋予蛋白质新的化学反应活性,还能作为药物先导化合物或材料构件,具有巨大的应用前景。
非天然氨基酸的获取并不容易,如何以低成本、环境友好的方式实现它们的大规模合成,始终是困扰科研和产业界的难题。
近日,华东理工大学联合浙江工业大学团队,在 Nature Communications 发表了一篇最新成果“Modular multi-enzyme cascades enable green and sustainable synthesis of non-canonical amino acids from glycerol”。研究团队提出了一种模块化多酶级联反应平台,以廉价且丰富的副产物甘油为原料,实现了 22 种非天然氨基酸的绿色合成,其中包括药物羧甲司坦(Carbocisteine)和抗艾滋病药奈非那韦(Nelfinavir)的主要成分。更重要的是,该方法具有较高的原子经济性(超过 75%),副产物几乎只有水,可顺利放大至十克级,为产业化生产提供了坚实的基础。
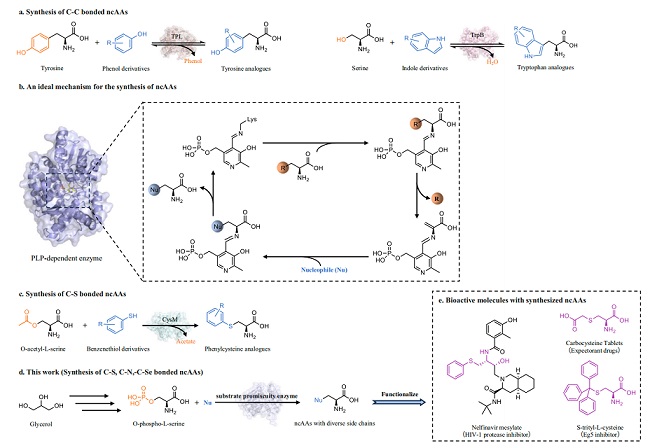
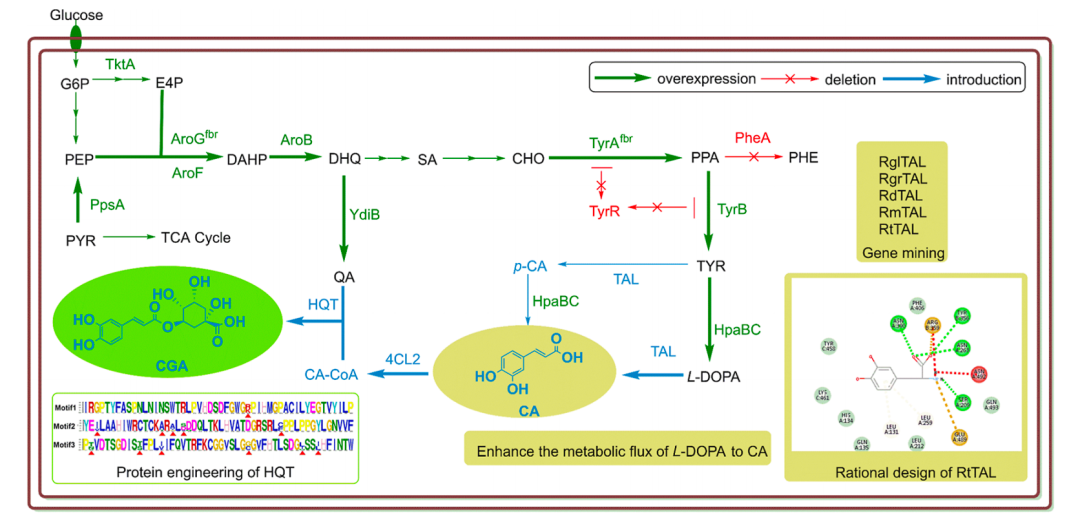
图 | 该模块化多酶级联系统的总体设计思路,从甘油逐步合成非天然氨基酸
该研究的关键理念是模块化。研究团队没有依赖单一反应,而是把整个合成过程拆分成若干功能模块。
第一步(氧化模块):在醛糖醇氧化酶(AldO)的催化下,甘油转化为 D-甘油酸;同时,副产过氧化氢通过过氧化氢酶降解,保证体系稳定;第二步(活化模块):D-甘油酸经甘油酸激酶(G3K)、磷酸甘油脱氢酶(PGDH)和磷酸丝氨酸转氨酶(PSAT)作用逐步转化为 O-磷酸-L-丝氨酸(OPS);第三步(组装模块):O-磷酸-L-丝氨酸巯基酶(OPSS)作为关键催化剂,能够与多种亲核试剂(硫醇、硒醇、唑类等)反应,形成多种 C–S、C–Se 和 C–N 键类型的非天然氨基酸。
这种思路的优势在于“即插即用”。只要更换第三步反应中的亲核试剂,就能得到完全不同的非天然氨基酸,可快速拓展产物谱。
不过在该路径中,OPSS 是关键瓶颈,天然的 OPSS 催化效率有限,尤其在处理复杂底物时效果不佳。为了突破限制,研究团队采用了定向进化策略,经过多轮迭代,研究人员获得了一个活性提升 5.6 倍的 OPSS 突变体,其在催化 C–N 键形成时活性提升显著,
这意味着原本效率低下的 C–N 键合成反应,现在可以在温和条件下快速进行,除了能更高效的生成传统的硫/硒取代类氨基酸,还可以在温和条件下获得带有氮杂芳香环的非天然氨基酸,丰富了最终产物的多样性。
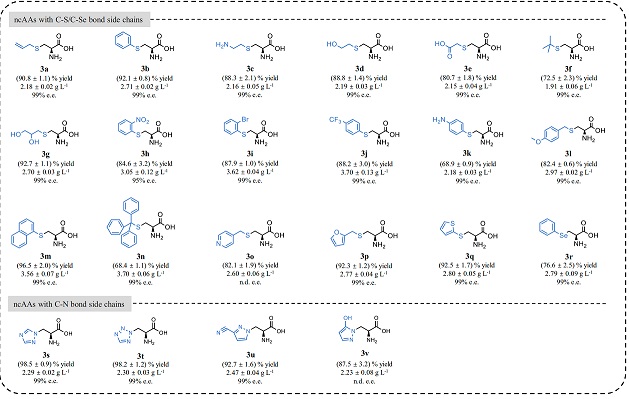
图 | 该模块化多酶级联平台成功合成的 22 种非天然氨基酸
最终,研究团队成功依托该平台合成了 22 种非天然氨基酸,涵盖含硫、含硒、含氮杂环等多个类别。其中包括临床常用治疗慢性阻塞性肺病的药物羧甲司坦(Carbocisteine)和抗艾滋病药物奈非那韦(Nelfinavir)的前体分子。
值得注意的是,这些分子在传统化学合成中步骤繁琐、条件苛刻,而在该平台中,只需几步生物催化即可完成。更重要的是,整个反应的副产物几乎只有水,不仅绿色环保,而且极大简化了后续的分离纯化过程。
在放大实验中,该平台在克级和十克级规模依旧保持较高产率。例如,以 150 mM 甘油为底物,可获得 9.5 g S-烯丙基-L-半胱氨酸,分离收率 68.4%。成本分析表明,其生产成本约为 455 美元/千克,仅为化学合成法的一半。副产物仅为水,显著降低了环境负担。
总之,该模块化多酶级联反应为非天然氨基酸的绿色合成提供了系统化解决方案。该方法不仅实现了从低价值副产物到高价值分子的升级转化,也在工业可放大性和环境可持续性上展现出优势。
随着技术不断成熟,这一平台有望成为未来医药和材料领域的重要支撑,为绿色化工和生物制造的发展开辟新路径。
参考文献:
https://www.nature.com/articles/s41467-025-63341-1
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。


























































































安各洛(深圳)生物科技有限公司 版权所有